GSK가 임상시험과정에서 약물 이상 반응을 제때에 보고하지 않아 10일 식품의약품안전처로부터 1차 경고처분을 받았다.
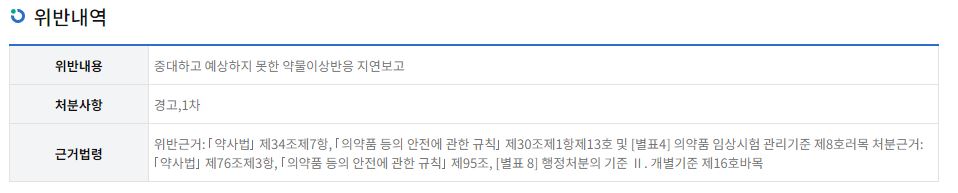
식약처에 따르면 GSK는 임상시험 과정에서 중대하고 예상하지 못한 약물이상반응을 보고받았지만 식약처에 늦게 전달했다고 밝혔다.
현재 약사법과 의약품 등 안전에 관한 규칙에서는 임상시험 의뢰자는 임상 과정에서 중대하고 예상치 못한 약물 이상 반응이 발생되면 중요도에 따라 보고하도록 하고 있다. 구체적으로는 사망을 초래하거나 생명을 위협하는 사안은 7일 내 보고해야하며 상세한 정보는 15일 이내에 마쳐야한다. 그 밖에 중대하고 예상하지 못한 약물 이상반응은 처음 보고받거나 알게된 날부터 15일 내에 보고해야한다.
만약 임상시험 관리기준을 준수하지 않은 업체는 1차 경고 조치 후 두 번째 위반을 하면 해당 임상시험이 15일간 정지된다. 이후 3차 위반 시에는 1개월, 4차 위반 시에는 3개월간 임상시험업무가 정지된다.
식약처는 위반근거를 약사법 제34조 제7항, 의약품 등의 안전에 관한 규칙 제30조 제1항 제13호 및 의약품 임상시험 관리기준 위반 등을 적시했지만 어떤 약물에 대한 어떤 임상시험인지는 공개하지 않았다.
박찬영 기자
admin@medisobizanews.com

