코로나19 사태로 전세계적으로 mRNA 백신ㆍ치료제에 대한 관심이 높아지면서 코로나 백신이외에 암 분야에서도 연구가 활발하게 진행되고 있다. 하지만 RNA 치료제 시장이 성장하려면 약물의 안정성 확립과 투자 지속성이 필요한 것으로 나타났다. RNA 치료제 장점은 DNA 기반 치료제가 세포질과 핵막을 통과해야 하는 반면, RNA 치료제는 세포질만 통과하면 세포 내 단백질의 활성을 조절할 수 있다. 따라서 RNA 치료제는 일반적으로 저분자로 약물을 투여할 수 없는 표적 분자에 작용할 수 있다.
생명공학정책연구센터는 글로벌 시장조사기관인 프로스트앤설리번의 자료 등을 토대로 '글로벌 RNA 치료제 개발 현황 및 산업 동향'(설민·김현수 연구원) 보고서를 8일 발간했다.
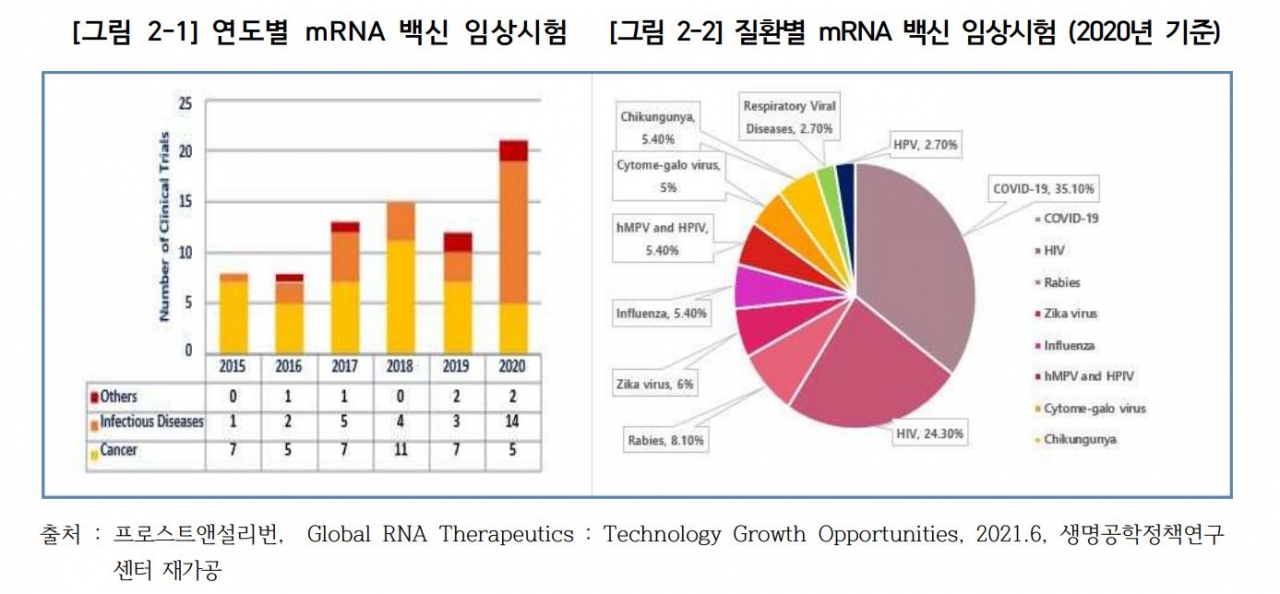
보고서에 따르면 2019년까지 mRNA 백신 임상은 대부분 항암제 위주로 연구가 진행됐으나 2020년부터 코로나19로 인해 감염성 질환 연구가 많아지고 있다. 특히 코로나 mRNA 백신은 1년도 되지 않아 화이자와 모더나가 개발한 백신이 상용화되기도 했다. 현재 글로벌 RNA 치료제 시장 규모는 2021년 49억3800만 달러에서 연간 17.6% 성장률을 보여 2030년에는 251억2200만 달러에 도달할 것으로 예상된다.
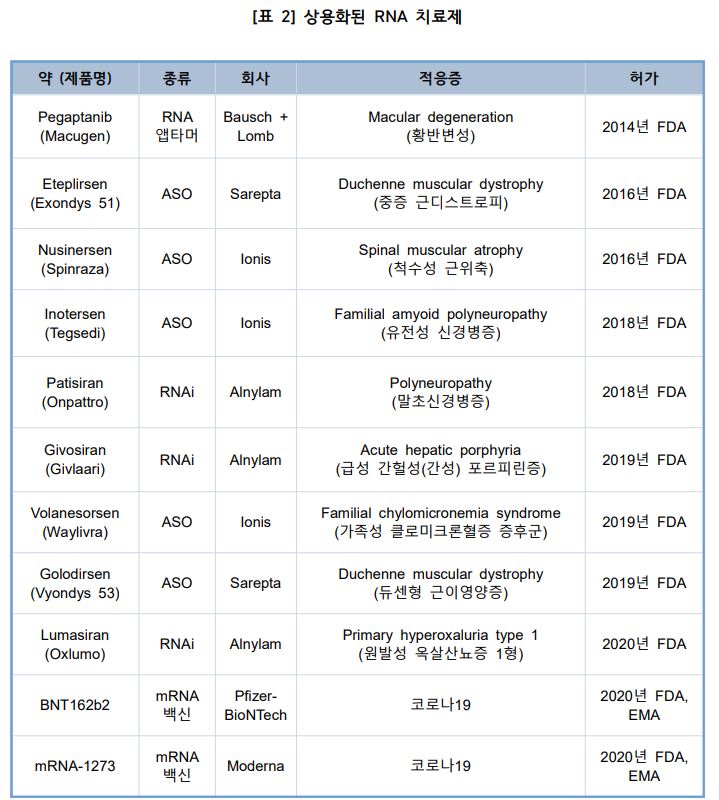
◇앨나일람ㆍ아이오니스에 이어 모더나도 연구에 박차
글로벌 RNA 치료제 부분의 개발 제약사는 앨나일람(Alnylam Pharmaceuticals), 아이오니스(Ionis Pharmaceuticals), 사렙타(Sarepta Therapeutics) 등 3개 기업이지만 최근 모더나, 큐어백, 바이오엔테크(BioNTech)가 코로나 팬더믹을 바탕으로 막대한 자금을 유치하기도 했다.
모더나는 선도적 mRNA 치료제 회사로 예방 백신, 암 백신, 면역종양학, 극소재생치료제, 전신 분비 및 세포 표면 치료제, 전신 세포 내 치료를 호함한 6가지 양식에 걸쳐 다양한 제품 포트폴리오를 보유하고 있다.
큐어백은 2000년 독일 튜빙겐에 설립된 회사로 화학적 염기수정 없이 천연 RNA를 사용하는 mRNA 기술을 보유하고 있다. 백신, 암 면역요법, 항체 및 희귀 질환에 대한 분자표적치료가 주요 연구 분야며 지난해 10월 13일 GSK와 제휴로 진행 중인 2세대 mRNA 개발에 초정을 맞추고자 1세대 mRNA 기반 코로나 백신 허가신청을 철회했다.
또 2008년에 설립된 바이온텍은 mRNA 치료제, 세포치료제, 항체 및 저분자 면역조절제 등 4가지 약물을 개발중이다. 면역 체계를 활성화하기 위해 수정된 mRNA 인코딩 항원 기술을 사용한 코로나 백신을 개발했다.
국가별로 보면 미국이 선두주자다. 미국은 코로나19 확산 이후에 RNA 치료제에 수십억 달러를 투자했다. 현재 대부분의 RNA 치료제 회사는 미국에 기반을 두고 있으며, 민간자금 또는 공공 자금의 지원을 받고 있다.
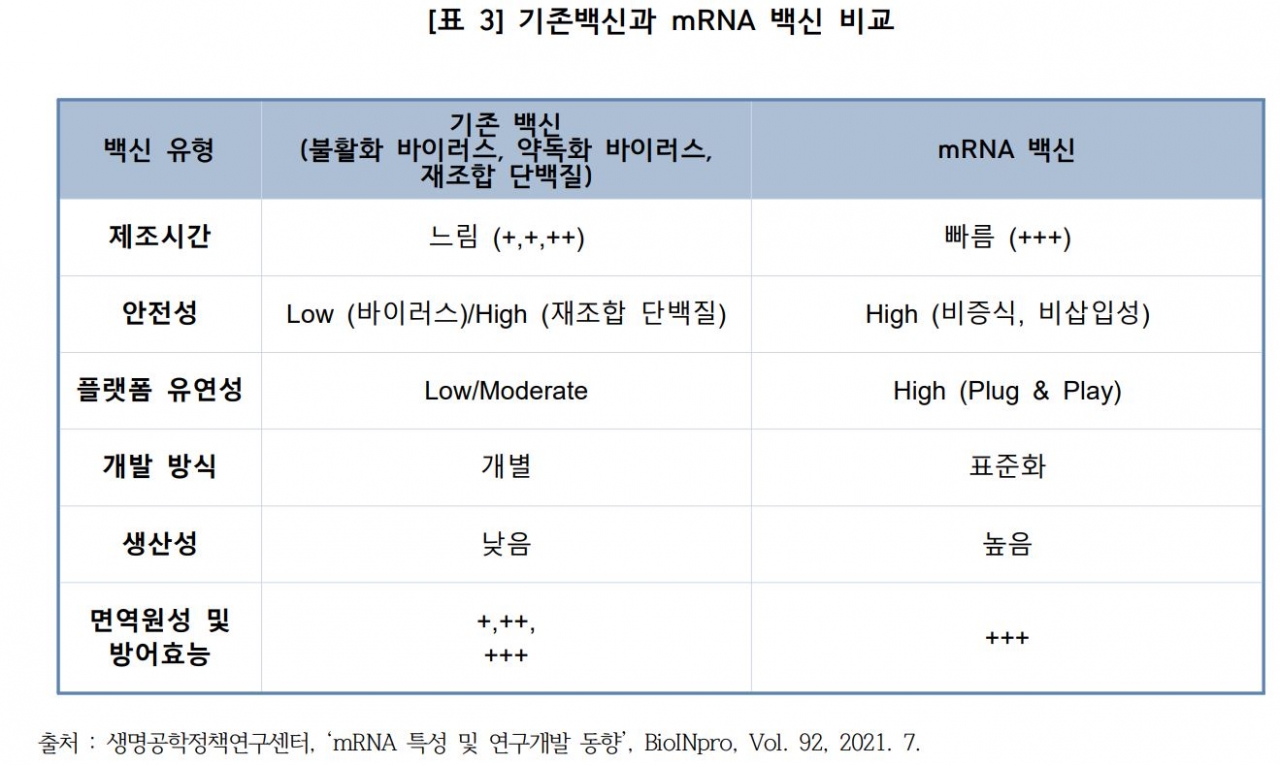
◇RNA치료제, 4개 분야를 중심으로 개발
보고서에 따르면 RNA 치료제는 DNA의 유전 정보를 바꾸지 않은 채 세포 내 단백질의 활성을 조절한다. RNA 치료제는 ▲mRNA 치료제 ▲RNA 치료제의 Trendsetter ▲추가적인 RNA치료제 ▲RNA 치료제를 위한 전달 시스템으로 나누어 개발이 진행되고 있다.
이 중 mRNA 치료제는 필수 유전자가 돌연변이 되거나 결핍된 단일 유전자 장애에서 누락된 단백질을 발현하기 위해 적극적으로 사용되었으며 항원 발현에 적용되어 코로나19 백신의 성공결과로 나타났다.
RNA 치료제의 Trendsetter의 경우 RNA간섭(RNAi) 및 안티센스 올리고뉴클레오티드(ASO)는 원치 않는 유전자의 발현을 억제하기 위한 탁월한 RNA 치료제로 대사질환, 심혈관질환, 희귀질환, 신경계질환, 암 치료제로 개발될 가능성이 높은 것으로 알려져 있다. 추가적인 RNA치료제 분야에서는 유전자 편집을 위한 mRNA 기반 CRISPR/Cas9의 발현, 암 치료를 위한 mRNA 기반 단일 클론 항체 및 면역 조절제, 자가 증폭 RNA 및 단기 활성화 등 다양한 분야에서 새로운 접근 방식이 시도되고 있다.
또 RNA 치료제를 위한 전달 시스템은 RNA 치료제의 성공 여부가 RNA 안전성, 면역원성 감소, RNA 분자의 표적 기관 전달에 있어 매우 활발한 연구 분야다. 지질 나노입자, 고분자, 펩타이드 기반, N-아세틸갈락토사민, 실리카 나노입자, 액소좀과 같은 RNA 조절과 안정성 및 전달 시스템의 다양한 메커니즘을 대상으로 연구가 진행되고 있다.
◇RNA 치료제 성공위해선 상온저장ㆍ운반기술 개선 이뤄져야
RNA 치료제가 성장하기 위해 몇 가지 문제점을 해결해야 한다.
우선 기술적인 문제로 RNA의 불안정성과 표적 기관 전달 한계 극복이다. 이 문제는 상온 저장ㆍ운반 기술 및 지질 나노입자 제형 개발 등으로 극복할 수 있다.
RNA는 불안정하고 핵산 분해효소에 의해 분해되기 쉬우며 제한된 반감기가 있다는 문제가 있다. 또 면역원성이며 저장ㆍ운송 및 배포에 저온 또는 극저온의 조건이 필요하다. 이 때문에 RNA를 보호하고 표적 기관에 RNA를 전달하는 새로운 시스템을 개발하는 것이 더 많은 RNA 치료제 개발을 촉진할 수 있다. 현재 대부분의 mRNA 백신은 초저온 콜드 체인으로 안정성의 한계를 극복하고 있지만 최근 에는 상온에서 mRNA 저장, 운반 기술이 개발되고 지질나노입자 제형이 개발되면 비용 절감 및 접근성이 용이해진다.
RNA는 자연적으로 깨지기 쉽고 영하의 온도에서도 활성산소, 잔류 핵산분해효소, 금속 이온 및 복합체 등 다양한 요인으로 인해 분해될 수 있다. 따라서 mRNA의 대량 저장 및 운송, 안정화에 관심을 쏟아야만 대량 적용 및 비용 절감이 가능해진다. 이를 위해서는 일반적인 냉장고 온도에서 안정된 액체 또는 동결건조분말제형과 같이 상온에서도 향상된 안정성을 가지는 차세대 제형이 필요하다.
RNA 치료제에 대한 투자 부족도 문제다. RNA 치료제는 가장 유망한 바이오 기술 중 하나임에도 불구하고 다른 바이오의약품에 비해 투자가 적으며 중소 기업 및 학술연구기관 주도로 성장하고 있는 실정이다. 2000년대 RNA 치료제에 많은 투자가 이뤄졌으나 대기업은 임상 및 상업적 성공의 부족으로 인해 RNA 치료제를 개발하는 회사와 파트너십을 종료했다. RNAi 승인으로 RNA 치료제 관심을 회복했지만 여전히 항체 및 저분자화합물과 같은 다른 바이오의약품에 비해 투자가 부족한 실정이다.
다만 코로나 mRNA 백신이 안정성과 유효성 및 생산 측면에서 매우 훌륭한 결과를 입증했다. 현재까지 RNA 치료제는 가장 빠르고 유망한 생물학적 치료법 중 하나로 향후 더 많은 투자가 필요할 전망이다.