통증 치료제로 쓰이는 프레가발린 성분 제제(단일제, 경구제)의 이상 반응에 ‘어지러움’이 추가된다.
식품의약품안전처는 16일 프레가발린 성분 제제에 대한 의약품 허가사항 명령 변경을 사전 예고했다. 식약처는 프레가발린 성분 제제의 재심사결과 등을 토대로 허가사항 변경(안)을 마련하여 의견조회를 실시한 바 있다. 사전 예고 기간은 1월 16일~1월 31일까지며 변경 명령 예정일은 2월 1일이다.
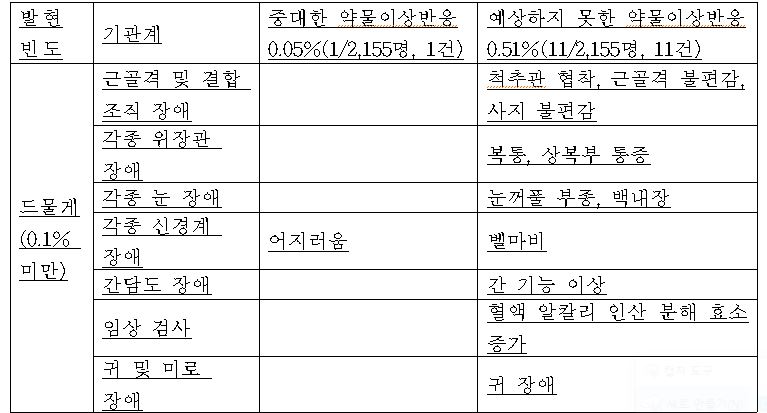
식약처는 “국내에서 재심사를 위하여 4년 동안 2155명을 대상으로 실시한 시판 후 조사 결과, 이상사례의 발현율은 인과관계와 상관없이 11.65%(251/2155명, 318건)로 보고되었다”면서 “이 중 인과관계를 배제할 수 없는 중대한 약물이상반응은 1건이며 인과관계를 배제할 수 없는 예상하지 못한 약물이상반응은 11건으로 나타났다”고 밝혔다.
중대한 약물 이상 반응은 0.05%로 극히 적었고 예상치 못한 약물 이상 반응도 0.51%에 그쳤다.
예상치 못한 약물 이상 반응에는 척추관 협착, 근골격 불편감, 복통, 상복부 통증, 눈꺼풀 부종, 백내장, 벨 마비 등이 보고되었다.
현재 시판되고 있는 프리가발린 성분 제품은 ▲지엘팜텍 카발린CR서방정300밀리그램, 카발린CR서방정150밀리그램 ▲엘지화학 젤리프서방정150밀리그램, 젤리프서방정300밀리그램 ▲ 지엘파마 슈프레가CR서방정150밀리그램, 슈프레가CR서방정300밀리그램 ▲유한양행 유한프레가발린서방정300밀리그램, 유한프레가발린서방정150밀리그램, 유한프레가발린서방정75밀리그램 ▲비아트리스코리아 리리카CR서방정82.5밀리그램, 리리카CR서방정165밀리그램, 리리카CR서방정330밀리그램 ▲대원제약 리카뉴로서방정150mg, 리카뉴로서방정300mg ▲한림제약 가바뉴로서방정300밀리그램, 가바뉴로서방정150밀리그램 등 7개사 16개 제품이 있다.