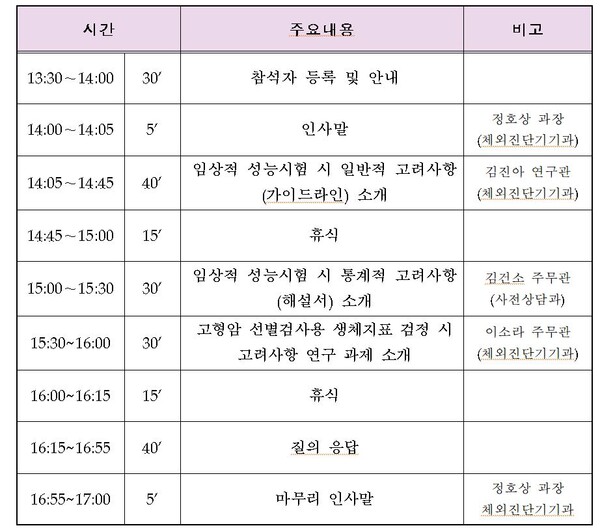
식품의약품안전처(처장 오유경)는 국내 체외진단의료기기 제조·수입 업체 종사자를 대상으로 최신 심사기준을 상세히 안내하기 위하여 ‘체외진단의료기기 허가심사 민원설명회’를 1월 30일 한국의료기기산업협회 대교육장(서울 강남구 소재)에서 개최한다.
이번 설명회에서는 국제 조화된 심사기준을 반영하여 지난해 12월 제정‧발간한 ‘체외진단의료기기 임상적 성능시험 시 일반적 고려사항’과 ‘체외진단의료기기 임상적 성능시험 시 통계적 고려사항’의 주요 내용을 설명한다.
아울러 최근 연구·개발이 활발하게 이루어지는 고형암 선별검사용 진단 기기의 제품화 지원을 위해 수행한 ‘고형암 선별검사용 생체지표 검정 시 고려사항 연구’의 결과도 소개한다.
참고로 사전 수요조사 결과 참석요청자가 많아 2월 중에 온라인으로 2차 민원설명회를 개최할 예정이며 상세한 일정은 정해지는 대로 안내할 계획이다.
식약처는 "이번 설명회가 체외진단의료기기의 임상적 성능 평가에 대한 업계의 이해도를 높이는 데 도움을 줄 것"이라고 밝혔다.
김은지 기자
admin@medisobizanews.com

