[메디소비자뉴스=오지혜 기자] 의약품 허가가 지난해 큰 폭으로 감소된 것으로 조사됐다.
식품의약품안전청(청장 이희성)은 지난해 의약품 허가(신고) 현황을 분석한 결과, 허가(신고)된 품목 수가 4733개로 2011년(8122개)보다 42% 가량 줄었다고 25일 발표했다.
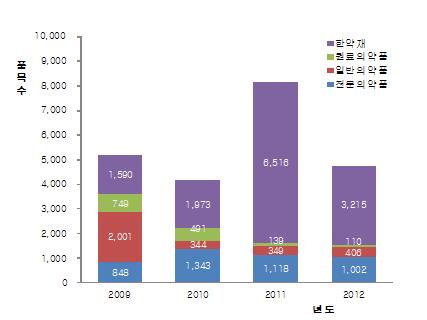
전문약과 원료약의 허가(신고) 품목 수는 2010년 이후 해마다 소폭 줄어들고 있지만, 일반약은 신경계 치료제 개발 등으로 증가되고 있다.
전문약은 2010년 1343개), 2011년 1118개, 2012년(1,002개)로, 원료약은 2010년 491개, 2011년 139개, 2012년 110개로 감소되고 있다.
반면 일반약은 2010년 344개, 2011년 349개, 2012년 406개로 늘어나고 있다.
식약청은 의약품 허가 감소에 대해 "한약재가 2011년(6516개)에 비해 지난해에는 3215개로 크게 감소됐기 때문"이라며 "2011년 10월부터 한약도매업소에서 한약재를 단순 가공하는 등의 행위를 금지함에 따라 그 해 한약재 허가(신고) 품목 수가 급증한 것"이라고 밝혔다.
지난해 국산신약에서는 일양약품의 슈펙트캡슐(백혈병 치료제) 100mg 및 200mg, LG생명과학의 제미글로정(당뇨병 치료제)이 허가됐고, 개량신약의 경우 안국약품의 '레토프라정20mg' 등 6개 품목이 허가되며 2011년보다 4품목이 늘었다.
수입에만 의존하던 희귀약도 지난해 국내에서 처음으로 녹십자의 ‘헌터라제(헌터증후군)’ 등 2품목이 허가됐다.
생물약은 바이오시밀러로 국내에서 개발된 셀트리온의 ‘램시마’가 세계 최초로 허가됐고, 세포치료제인 안트로젠의 '큐피스템(크론병)’ 2품목이 허가되기도 했다.
식약청은 국내 제약산업의 지원 및 수출 경쟁력 강화를 위해 규제 선진화, 사전검토제 운영, 최신 과학기술개발에 따른 평가체계 구축을 통해 의약품 허가를 합리적으로 지원할 방침이다.
자세한 내용은 홈페이지(www.kfda.go.kr)정보자료 → 매뉴얼/지침 → 2012 허가보고서에서 조회할 수 있다.

