[메디소비자뉴스=강은희 기자] 화학 제네릭과 달리 고비용 구조를 지닌 바이오시밀러에는 개발, 생산, 임상개발, 상업적 판매 등 다양한 면에서 상당한 수준의 진입장벽이 존재한다.
바이오시밀러를 개발하는 메이커는 공정개발에서 생산할 때까지 특허분쟁의 여지를 피해야 하고, 비교동등성을 증명해야 한다. 따라서 개발내내 바이오시밀러에 대한 유전적, 바이오 분석적으로 특성을 파악해야 한다. 또한 생산공정에 있어서도 살아있는 유기체를 배양해야 하는 만큼 상당한 노하우를 필요로 한다.
바이오의약품은 대부분 난치성치료제이면서 복수의 적응증을 가지고 있기 때문에, 바이오시밀러의 임상개발에서 목표적응증 설정에 따라 임상디자인(피험자수, 투약기간 등)이 달라질 수 있어 목표적응증 설정이 매우 중요하다.
이와 더불어 바이오시밀러가 상용화되고 있는 유럽에서도 의사의 동의 없이는 대체조제를 허락하지 않고 있어 광범위한 임상을 실시해 안전성을 증명하는 것 또한 필요하다. 이에 따라 바이오시밀러는 임상개발에 있어서도 고비용 구조를 지니고 있고 이는 진입장벽으로 작용한다.
글로벌 주사제 제네릭 1위 메이커를 자랑하며 유럽 바이오시밀러 시장에 참여하고 있는 미국 호스피라는 바이오시밀러 투자에는 여러 리스크가 수반되지만, 잠재적 이득은 클 것이라고 최근 포럼을 통해 밝혔다.
호스피라가 밝힌 것처럼 항체 바이오시밀러의 개발과 상업화에 드는 비용이 높은 만큼, 진입장벽은 더 높아질 것으로 예상된다. 따라서 임상에서 안전성 확보, 마케팅 능력, 원가경쟁력이 항체 바이오시밀러 개발투자에 대한 이득의 정도를 결정할 것으로 보인다.
국내 다수업체가 항체 바이오시밀러 개발에 열을 올리고 있고, 일부 업체는 의미있는 진척을 내고 있다. 국내사 중 현재까지 바이오시밀러 임상개발을 진행 중인 회사는 셀트리온, 한화케미칼, LG생명과학에 불과하다. 이는 전임상 단계에서 대조약 대비 비교동등성을 증명해 임상단계에 진입하는 것이 쉽지 않음을 반증한다.
LG생명과학 박철하 총무팀장은 "바이오시밀러를 개발하는 데 있어 특히 설비나 노하우면에서 일반 제네릭과 상당히 차이가 있기 때문에 가격도 비싸고 품질관리측면에서도 어려운 점이 있다"고 말했다.
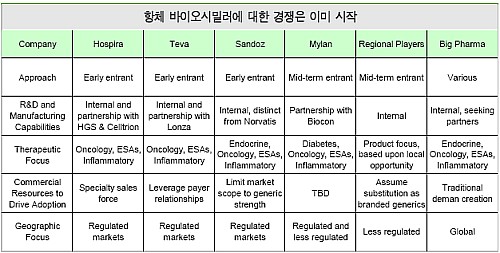
항체 바이오시밀러에 대한 글로벌 경쟁은 이미 시작됐다. 글로벌 주요 제네릭 메이커들은 대부분 파트너링을 마쳤고, 다국적 제약사들은 자체적으로 추진하거나 파트너를 물색 중이다. 호스피라사는 “바이오시밀러에 있어서 조기진입보다는 올바른 시점 진입이 상업적 성공의 열쇠”라고 강조했다.
하지만 세계 3대 바이오시밀러 메이커인 미국의 호스피라, 이스라엘의 테바, 스위스의 산도즈 모두 바이오시밀러에 있어 조기진입을 목표로 하고 있는 만큼, 시장선점이 중요한 요소가 될 것으로 예측된다.
한편, 지난해 유럽 바이오시밀러 시장은 1억 달러에 이르렀으며 이중 산도스의 점유율은 48%, 호스피라는 24%, 테바는 23%를 기록했다.

