국내 기술로 개발된 인공심장판막이 허가를 받았다.
서울대병원 소아청소년과 김기범(사진) 교수팀은 태웅메디칼과 2년간 임상 결과 효과 및 안전성이 입증된 인공심장판막이 최근 식품의약품안전처의 시판 허가를 취득했다고 25일 밝혔다.
병원 측에 따르면 김 교수팀은 2004년부터 폐동맥인공심장판막 개발에 뛰어들었고, 보건복지부 지원 바이오이종장기사업단을 통해 돼지와 소 심장 외막을 이용한 인공심장판막 개발을 시작했다.
김 교수팀은 개흉수술 대신 피부를 통해 간단히 판막을 이식하는 스텐트 개발도 동시에 진행했다. <그림 참조>
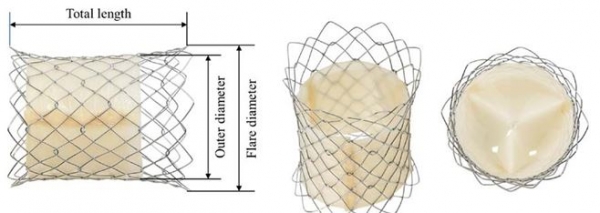
동물실험을 거쳐 지난 2016년부터 진행된 임상을 통해 환자 10명에게 이식하고 6개월 추적 관찰한 결과, 이종이식의 가장 큰 문제점인 면역거부반응이 거의 없었고 면역억제제도 필요없는 것으로 나타났다는 게 연구팀의 설명이다.
연구팀은 "심장엔 혈액순환을 조절하는 판막 4개가 있는데,가장 흔한 판막질환은 대동맥의 판막 협착"이라며 "그러나 대동맥 인공판막은 이미 미국 등 선진국에서 개발한 타비(TAVI)라고 불리는 스텐트-인공심장판막이 상용화되고 있다. 이번에 개발된 '스텐트 이식 폐동맥 인공판막'은 세계 처음 상용화된 제품으로 그간 한국과 미국, 중국이 치열하게 경쟁해 왔었다"고 밝혔다.
이어 "현재 외국에서 개발돼 쓰이고 있는 제품은 개당 3000만~4000만원에다 10년마다 판막을 교체해야 했지만, 이번 국산 판막은 처음부터 가슴 절개 없이 정맥을 통한 시술이 가능하다"며 "수입판막을 대체할 뿐 아니라 스텐트가 견고하고 폐동맥 크기에 유연하게 맞출 수 있어 앞으로 환자들의 수술과 경제적 부담을 한층 덜 것"이라고 강조했다.
김 교수는 “현재 국내 여러 병원에서 추가 임상이 진행 중"이라며 "내년초부터 유럽 내 임상(허가임상)을 실시해 유럽 인증(CE)을 받으면 환자 삶의 질 향상과 한국 의료기술의 세계화에 더 기여할 것”이라고 기대했다.
이번 연구는 지난 6월 미국 심장학회저널 '혈액순환,중재시술(Circulation, Cardiovasc intervention)’에 소개됐다.


