항암제 '에토포시드' 주사제 이상반응에 급성 신부전증이 신설됐다.
식품의약품안전처는 미국식품의약국(FDA)의 에토포시드 제제 관련 안전성 정보에 대한 검토 결과에 따라 이같은 허가 사항 변경안을 12일 마련했다.
조혈모세포 이식을 위해 에토포시드 고용량(2220mg/m²) 투여 및 전신조사(total body irradiation) 후 가역성 급성 신부전증 발병이 보고됐다.
급성 신부전증은 덱스트란 40이 들어있는 에토포시드 제제를 고용량으로 투여한 것과 연관돼 있다고 식약처는 설명했다. <표1 참조>

에토포시드는 신장계 이상반응과 관련해 기존 때때로 'BUN(혈액요소질소), 크레아티닌 상승, 요단백이 나타날 수 있다'에 급성 신부전이 추가된 것이다.
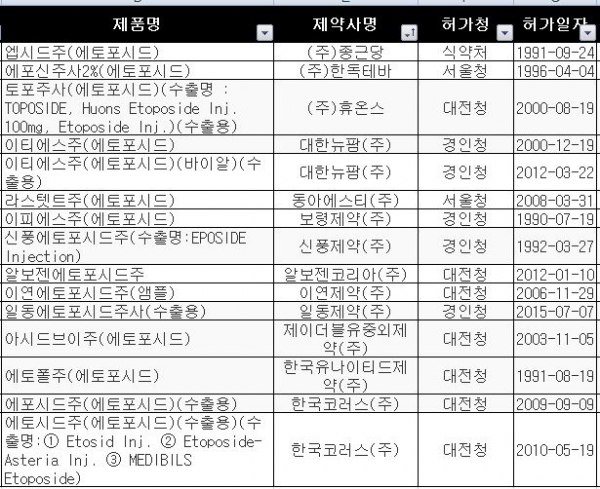
이 제제는 '에포신주사2%'(한독테바), '이티에스주'(대한뉴팜), '이연에토포시드주'(이연제약), '에포시드주'(한국코러스), '알보젠에토포시드주'(알보젠코리아) 등 15개 품목(수출용 포함)이 허가됐다. <표2 참조>
한편 이 변경안에 대한 의견서는 오는 29일까지 식약처(의약품안전평가과)에 제출하면 된다.
오지혜 기자
admin@medisobizanews.com

