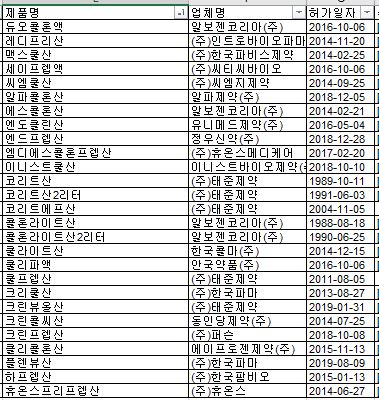
X선조영제 '코리트산'(사진ㆍ태준제약) 등 폴리에틸렌글리콜 제제 27개 품목의 허가 사항이 변경된다.

식품의약품안전처는 미국식품의약국(FDA)의 폴리에틸렌글리콜 제제의 안전성 정보에 대한 검토 결과에 따라 허가 사항을 변경한다고 내달 5일까지 의견 조회했다.
이 제제는 빈맥 등 이상반응이 다수 추가됐다.
심혈관계는 빈맥, 심계항진, 고혈압, 부정맥, 심방세동, 말초부종, 심장무수축, 급성폐부종, 실신, 탈수증이 보고됐다.
위장관계는 말로리바이스 째짐으로 인한 상부 위장관 출혈, 식도천공(주로 위식도역류질환 동반), 신경계는 진전, 발작 등이다.
아나필락시스 반응, 발진, 두드러기, 가려움증, 입술붓기, 혀부종, 얼굴부종, 호흡곤란, 가슴긴장, 목구멍긴장, 콧물, 피부염, 열, 오한 등 과민반응도 포함됐다.
신기능 장애와 신부전의 신장계 이상반응도 신설됐다.
이 제제는 듀오콜론액(알보젠코리아), 레디프리산(인트로바이오파마), 맥스쿨산(한국파비스제약), 세이프렙액(씨티씨바이오), 씨엠쿨산(씨엠지제약), 알파콜론산(알파제약), 엔도클린산(유니메드제약), 엔드프렙산(정우신약), 엠디에스콜론프렙산(휴온스메디케어), 이니스트쿨산(이니스트바이오제약), 쿨라이트산(한국콜마), 쿨리파액(안국약품), 크리쿨산(한국파마), 크린콜씨산(동인당제약), 크린프렙산(퍼슨), 클리콜론산(에이프로젠제약), 플렌뷰산(한국파마), 하프렙산(한국팜비오), 휴온스프리프렙산(휴온스) 등 27품목이 허가됐다. <표 참조>
김영우 기자
admin@medisobizanews.com

