
호주 연구자들이 세계 최초로 유전자 편집기술을 이용한 자궁경부암 치료 쥐 동물실험에서 암 덩어리를 완전히 제거해 항암치료제 개발에 큰 의미를 주었다.
그리피스대학 연구진은 세포의 DNA 서열을 변화시키는 유전자가위 기술 ‘CRISPR-Cas9’을 사용해 자궁 경부암에 걸린 실험 쥐 100%를 생존시켰다.
연구진은 E7 유전자를 표적 치료하기 위해 ‘스텔스’ 나노입자를 혈관에 투입, 암세포 DNA 염기서열을 바꿨다. E7은 인간 유두종바이러스(HPV)로부터 유발되는 암에서 발견되는 유전자로 연구진은 5년에 걸쳐 이 나노입자로 E7의 DNA를 잘못 인식하게 하거나 더 이상 만들어지지 못하도록 했다.
연구를 이끈 수석 연구원 니겔 맥밀런 교수는 “이 기술은 단어에 몇 글자를 추가해 맞춤범 검사기가 오자를 인식하지 못하도록 하는 것과 같다”며 “이 유전자가 있어야만 암세포가 활동할 수 있기 때문에 유전자 편집을 하면 암세포가 죽고 종양도 사라진다”고 말했다.
맥밀런 교수는 “다른 암들도 표적 유전자를 알아낼 수 있다면 같은 방법으로 치료할 수 있을 것으로 예측한다”며 “향후 5년 내에 인간에 대한 임상 실험에 돌입할 계획”이라고 밝혔다.
이어 “자궁경부암은 2012년 전 세계 여성 중 암 사망의 4번째로 매년 26만5000명이 사망하고 52만7000명이 새로 발병한다”며 “5년 생존율은 20년 동안 변하지 않아 현재의 치료 전략은 효능이 정점에 이르렀다”고 강조했다.
연구진에 따르면 암을 유발하는 고위험 HPV의 경우 종양 단백질(E6, E7)의 지속적인 발현이 필요하며 이 발현이 안되면 세포의 노화 또는 자멸을 초래한다. 따라서 E6 또는 E7 바이러스 단백질을 억제하면 세포주기 정지 및 세포 사멸을 초래한다고 결론지었다.
또 E7 유전자 불활성화가 세포 노화를 일으키는 망막아세포종단백질(pRb) 경로의 재확립과 관련돼 있음이 밝혀졌다. 다른 한편으로 E6 단백질의 억제는 마치 경찰과 같은 p53 경로를 재활성화시켜 세포 노화와 세포 자멸사를 초래한다고 보고 있다.<그래픽 참조>
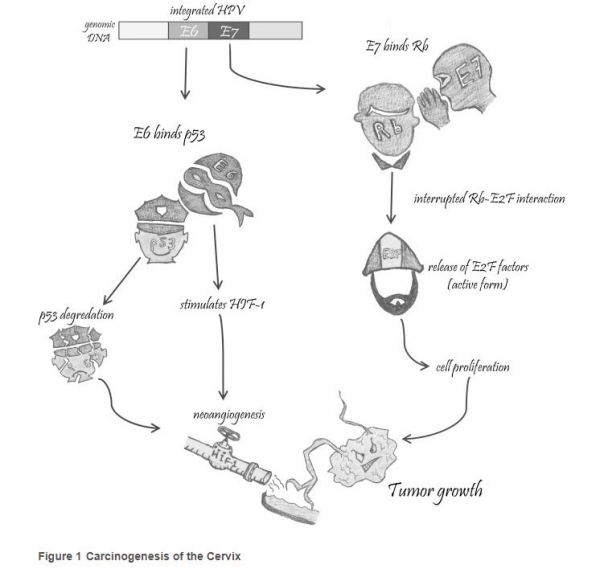
맥밀런 교수는 "자궁경부암의 발암 과정은 ‘발암 기억 상실 이론’과 일치한다"며 "이것은 초기 HPV 감염과 암 발병까지 오랜 시간이 걸려 여러 후성 유전학적 및 유전적 변형이 수반되는 것과 일맥상통하다"고 말했다.
그는 또 "이러한 변형은 세포 사멸과 게놈 무결성에 중요한 체크 포인트 메커니즘을 재정의하는 프로세스와 관련이 있다"고 설명했다.
이번 연구 결과는 학술지 ‘모레큘러 세라피(Molecular Therapy)’ 최근호에 실렸다.

