미국 바이오제약사 디사이페라 파마슈티컬스(Deciphera Pharmaceuticals)는 진행성 위장기질종양(GIST) 치료제 '리프레티닙’(Ripretinib)'을 미국식품의약국(FDA)에 신약 허가 신청(NDA)을 했다고 16일(현지시간) 발표했다.
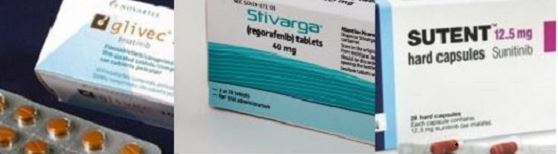
미국 FDA는 올 10월 리프레티닙을 노바티스 '글리벡', 바이엘 ‘스티바가’, 화이자 ‘수텐’으로 치료에 실패한 중증 GIST(기스트) 환자를 위해 심사 기간을 단축해주는 혁신 치료법 BTD(Breakthrough Therapy Designation)로 승인한 바 있다.
기스트는 식도부터 직장까지 소화기관의 근육층에서 발병되는 암의 일종을 가리킨다.
회사 측에 따르면 리프레티닙은 올해 진행성 GIST 환자 129명을 대상으로 한 임상에서 무진행 생존 기간(PFS) 개선에 대한 1차 평가 변수가 달성했다. 이 신약에 대한 치료군의 PFS 중앙값은 6.3개월인 반면 위약군의 PFS 중앙값은 1.0개월로 나타났다.
특히 리프레티닙은 위약보다 질병 진행 또는 사망 위험을 85% 가량 감소시킨 것으로 입증됐다고 회사 측은 설명했다.
FDA는 신속한 승인을 위해 실시간 종양학 리뷰인 'RTOR(Real-Time Oncology Review)' 파일럿 프로젝트로 평가키로 했다. 이 프로젝트를 통해 회사는 FDA와 최상위 데이터를 공유할 수 있다.
RTOR이 적용되면 공식적인 신청 절차 완료 전에 FDA의 자료 심사가 가능해 허가 검토가 빨라진다는 장점이 있다고 회사 측은 강조했다.
김영우 기자
admin@medisobizanews.com

