말단비대증치료제 '옥트레오티드' 제제와 급성백혈병치료제 '다우노르비신' 제제의 주사제 2종에 대한 투약 주의가 잇따라 당부됐다.
이 두 주사제의 이상반응에 옥트레오티드는 '담석증', 다우노르비신은 '뇌병증'이 각각 신설됐다.
식품의약품안전처는 이 주사제 2종에 대한 국내외 현황 등을 바탕으로 허가 사항 변경을 21일 지시했다. 이 주사제들은 모두 내달 21일 허가 사항이 변경될 예정이다.
옥트레오티드 주사제를 투여한 환자에게서 시판 후 담낭절제술이 필요한 담낭염, 담관염, 췌장염과 같은 합병증을 초래하는 담석증이 보고됐다.
식약처는 주기적으로 환자를 관찰해야 하며, 만약 담석증의 합병증이 의심된다면 이 약을 중단하고 적절히 처치해야 한다고 주의를 당부했다.
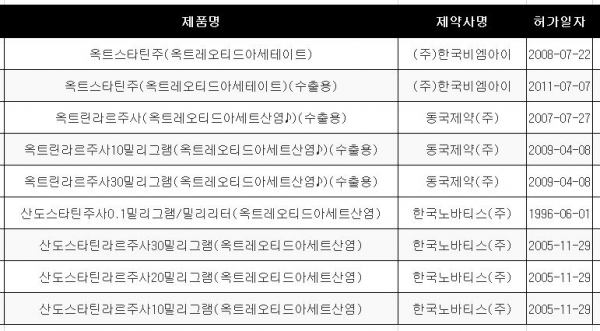
옥트레오티드 제제는 산도스타틴ㆍ산도스타틴라르(노바티스) 4개 품목을 비롯해 옥트스타틴(한국비엠아이) 2품목, 옥트린라르(동국제약) 3품목의 9품목이 허가됐다. <표1 참조>
또 다우노르비신 주사제는 치명적 결과를 불러오는 '가역적후뇌병증증후군(Posterior Reversible Encephalopathy SyndromeㆍPRES)'과 '가역적후두부뇌병증증후군(Reversible Posterior Leukoencephalopathy SyndromeㆍRPLS)'의 투약 사례가 보고됐다.
식약처에 따르면 PRES는 두통, 발작, 졸음증, 착란, 실명, 그 외 시각장애 및 신경장애를 나타내는 신경질환으로 경증에서 중증의 고혈압이 나타날 수 있다. 자기공명영상(MRI)은 PRES에 대한 진단을 확인하기 위해 필요하다. PRES 환자는 다우노루비신 치료의 중단을 고려해야 한다고 식약처는 강조했다.
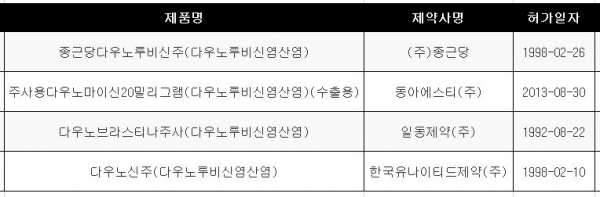
다우노르비신 제제는 다우노브라스티나(일동제약), 주사용다우노마이신20밀리그램(수출용ㆍ동아에스티), 다우노신(한국유나이티드제약), 종근당다우노루비신주(종근당)의 4품목이 허가됐다. <표2 참조>