류마티스관절염치료제 '올루미언트'(릴리), '엔브렐ㆍ젤잔즈'(화이자) 등 10개 품목의 허가 초과 약제 비급여 사용 승인이 불발됐다. <표 참조>
건강보험심사평가원은 코로나19(2019-nCoV) 치료에 투약하려는 올루미언트정 2ㆍ4mg을 비롯해 재발성 연골염 관련 엔브렐주사, 피부근염 및 탈모 환자에 사용하려는 젤잔즈정 5mg 및 젤잔즈 등 10품목의 허가 초과 약제 비급여 사용 불승인 사례를 12일 공개했다.
이 약제들은 대부분 의학적 근거 불충분으로 승인을 받지 못했다.
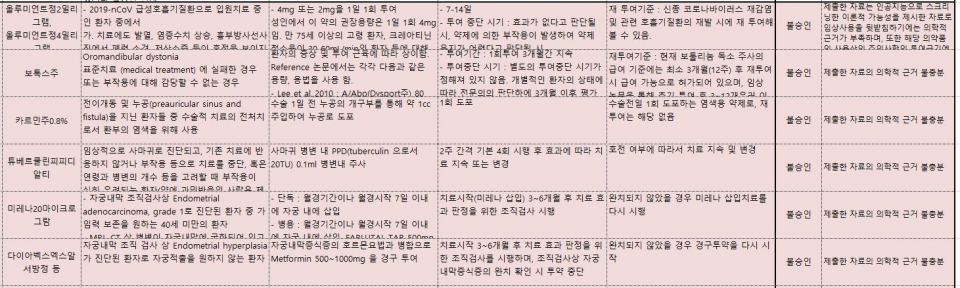
올루미언트는 2019-nCoV 급성호흡기질환으로 입원 치료 중인 환자 중에서 치료에도 발열, 염증 수치 상승, 흉부방사선 사진에서 폐렴 소견, 저산소증 등이 호전을 보이지 않거나 악화되고 있는 환자와 함께 바이러스성 폐렴의 사망률을 예측할 수 있는 'MuLBSTA score'가 높은 환자 등의 사용이 불발됐다.
이 약은 사용상 주의 사항의 투여 금기에 감염 환자에게 쓰지 말도록 하고 있고, 감염률을 증가시킨다는 경고도 있어 승인되지 못했다. 또 제출한 자료가 인공지능으로 스크리닝한 이론적 가능성을 제시한 자료로 임상 사용을 뒷받침하기엔 의학적 근거가 부족하기 때문이다.
엔브렐도 스테로이드와 기존 면역억제 치료에 불응하거나 부작용으로 이 약을 투여할 수 없는 재발성 연골염 환자에게 사용 승인이 신청됐지만 의학적 근거 부족으로 불승인됐다.
젤잔즈정5mg과 젤잔즈정도 각각 기존 면역억제 치료 불응성 피부근염 환자, 중증 원형 탈모 환자 등에 대한 사용이 불발됐다. 이 중 탈모와 연관돼 전체 두피의 면적 80% 이상(SALT score≥80)에 탈모가 발생한 중증의 원형 탈모 환자로서 전신 탈모, 전신 스테로이드 혹은 사이클로스포린 3개월 투여에 불응하거나 부작용으로 치료를 지속할 수 없는 환자 투약의 의학적 근거가 불충한 것으로 심의됐다.
보툴리눔 톡신 제제인 '보톡스주'와 신기능검사 의약품인 '카르민주0.8%' 역시 표준치료(medical treatment)에 실패한 때 또는 부작용에 대해 감당할 수 없는 때, 전이개동 및 누공(preauricular sinus and fistula)을 지닌 환자들 중 수술적 치료의 전처치로 환부의 염색을 위해 사용에 대해 의학적 근거 불충분으로 각각 불승인됐다.
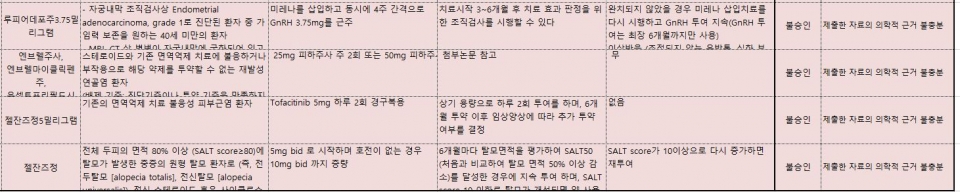
이밖에 결핵감염진단제 '튜베르쿨린피피디알티', 호르몬제 '미레나20㎍'과 '루피어데포주3.75mg', 당뇨병치료제 '다이아벡스엑스알서방정'도 각각 의학적 근거 부족으로 허가 초과 약제 사용을 승인받지 못했다.
이 제도는 의학적 근거가 부족하거나 안전성이 우려되는 약제 사용을 사전 예방해 안전한 의약품 사용을 도모하고, 국민과 의료기관의 알권리 및 편의를 증대하기 위해 시행되고 있다. 이와 관련해 이번 10품목이 추가되며 지금까지 총 183품목 사례가 공개됐다.