생물학적제제(백신ㆍ혈장분획제제 등)의 위해도 평가를 위한 세부 지침이 마련됐다.
식품의약품안전처는 백신과 혈장분획제제, 항독소, 보툴리눔 제제의 국가출하승인 의약품 검정 항목 차등화를 위해 위해도 단계(4단계) 평가 기준을 강화한 세부 지침을 마련, 24일 안내했다.
국가출하승인은 백신 생물학적제제에 대해 제품 판매 전 제조 단위별로 국가에서 검정시험 및 ‘제조 및 품질관리 요약서’ 등의 자료를 종합 검토, 품질을 확인하는 제도를 말한다.
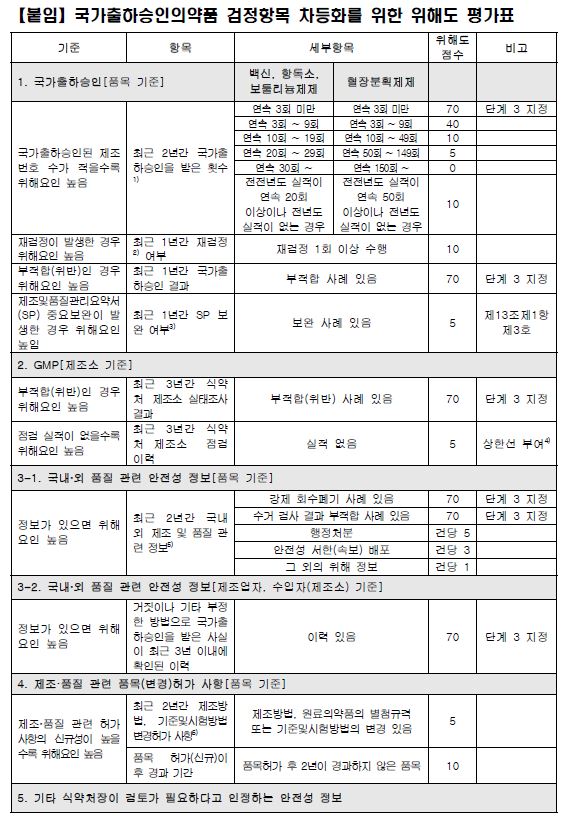
위해도 단계는 총 4단계(단계1ㆍ2aㆍ2bㆍ3)로 구분되고, 품목별 단계에 따른 국가출하승인 검정 항목이 차등화된다.
구체적으로 단계 1은 서류 평가, 단계 2(2aㆍ2b)는 서류 평가+안전성ㆍ유효성 관련 주요 항목 검정인데, 단계 2a와 단계 2b로 구분됐다.
단계 2a는 단계 1+성상 및 역가 확인 시험 등 주요 안전성ㆍ유효성 항목 검정이고 단계 2b는 단계 2a+그 외 안전성ㆍ유효성 항목 추가 검정으로 세분화됐다. 단계 3은 서류 평가+모든 항목 검정이다.
검토 항목은 국가출하승인 실적, 제조소 실태조사 결과, 국내외 품질 관련 안전성 정보, 허가 사항 변경 등이며, 항목별 세부 평가 기준은 국가출하승인의약품 위해도 평가표<표 참조>에 따라 검토 항목별 위해 요소를 평가하되, 기타 식약처장이 필요하다고 인정하는 안전성 정보가 있을 때엔 별도로 평가할 수 있도록 했다.
이와 관련해 식약처(바이오의약품품질관리과)는 국가출하승인 의약품의 검정 항목 차등 관리를 위한 종합적 위해도 단계 평가 세부 지침을 마련함으로써 업무의 일관성 및 투명성, 효율성을 확보할 것으로 기대하고 있다.
식약처는 최근 서류 조작 등의 사건 발생에 따른 안전성 우려 및 허위 조작 행위가 국민건강에 중대한 영향을 끼치고 있어 이에 거짓으로 국가출하승인을 받은 의약품에 대한 위해도 평가 기준을 이처럼 강화했다고 설명했다.

