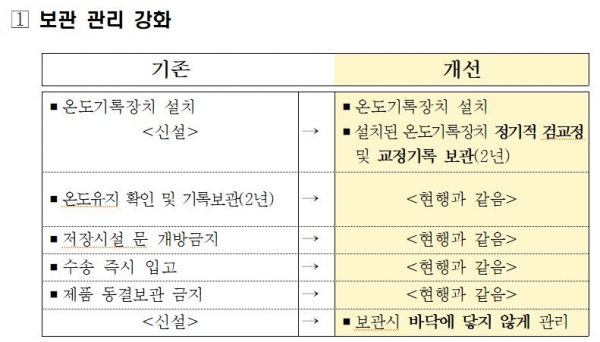
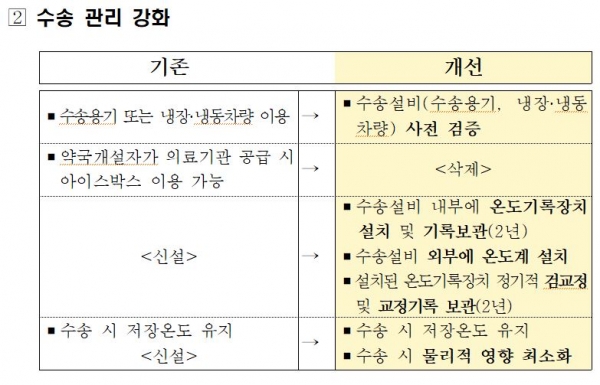
식품의약품안전처(처장 김강립)는 생물학적 제제 등 바이오의약품의 보관ㆍ수송 관리 강화를 위해 '생물학적 제제 등의 제조ㆍ판매관리 규칙' 개정안을 29일 입법예고했다. <아래 표 참조>
생물학적 제제 등 바이오의약품은 사람이나 다른 생물체에서 유래된 것을 원료 또는 재료로 해 제조한 의약품으로 보건위생상 특별한 주의가 필요한 제제이며, 백신, 혈액제제․혈장분획제제, 유전자재조합의약품, 세포치료제, 유전자치료제 등이 포함된다.
이번 개정안의 주요 내용은 ▲보관 관리 강화 ▲수송 관리 강화 ▲출하증명서 개선 등이다.
이를 위해 판매자는 생물학적 제제 등을 바닥에 직접 닿지 않게 둬야 하고, 냉장ㆍ냉동 보관하는 때 설치된 자동온도기록장치를 검ㆍ교정해야 하며 그 기록을 2년간 보관토록 한다.
또 판매자가 생물학적 제제 등을 운송하려면 수송용기와 냉장ㆍ냉동차량 내부에 자동온도기록장치를 설치토록 했다. 수송 용기는 추가적으로 외부 온도계 부착된다. 아울러 수송 과정에서 보관온도를 유지하는지 사전에 검증해야 하고, 수송 온도 기록을 2년간 보관해야 한다고 식약처는 설명했다.
식약처는 생물학적 제제 등의 수송 과정에서 온도 유지 여부를 확인할 수 있도록 출하증명서 양식도 변경할 방침이다.
판매자는 수령자에게 생물학적 제제 등을 인계하는 때엔 온도를 기재하고 수령자의 서명을 받아 출하증명서를 직접 보관해야 하며, 수령자가 요청하는 때엔 그 사본을 제공해야 한다. 이와 연관돼 출하증명서의 관리가 쉽도록 전자문서 보관이 허용된다.
식약처는 냉장ㆍ냉동 보관 등 취급에 주의가 필요한 생물학적 제제 등이 제조 단계부터 유통ㆍ사용에 이르는 모든 과정에서 품질이 유지돼 안전한 의약품이 공급될 수 있도록 관계 부처와 협력, 지속적으로 관리 체계를 개선해 나가기로 했다.
한편 식약처는 이 개정안에 대한 의견을 내년 2월8일까지 의견을 받는다.