SK바이오사이언스의 코로나19 백신 ‘GBP510'가 31일 식품의약품안전처로부터 코로나19 백신 1/2상 임상 승인을 받았다.
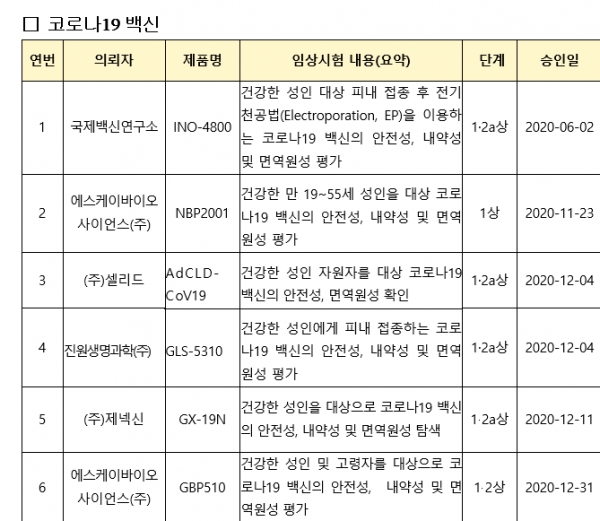
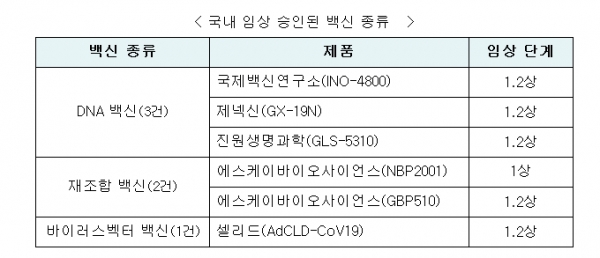
국제백신연구소(코드명: INO-4800),SK바이오사이언스(NBP2001),제넥신(GX-19N),진원생명과학(GLS-5310),셀리드(AdCLD-CoV19)에 이어 6번째 국내 개발 코로나19 백신으로 아직은 초기 단계이다.<표 참조>
이번 임상시험은 건강한 성인을 대상으로 ‘GBP510’의 안전성 및 면역원성(바이러스 감염성을 없애거나 낮추는 ‘중화항체’ 증가 비율)을 평가하기 위한 것으로 1상 진행 후 2상을 순차적으로 진행하게 된다.
‘GBP510’은 코로나19 바이러스의 ‘표면항원 단백질’을 유전자 재조합 기술을 이용해 만든 ‘재조합 백신’이라고 식약처는 설명했다.<표 참조>
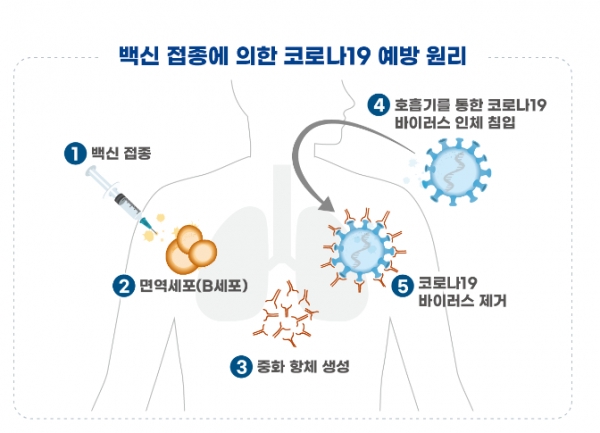
예방원리는 백신의 표면항원 단백질이 면역세포를 자극하여 중화항체를 형성해 면역반응을 유도하며, 코로나19 바이러스가 침입하는 경우 항체가 코로나19 바이러스를 제거하게 된다.<그림 참조>
이 회사는 지난11월 23일 재조합백신 ‘NBP2001’에 대한 임상 1상을 승인받았는데, 이 백신은 코로나19 바이러스의 표면 항원 단백질로 면역반응을 유도하고, ‘GBP510’는 표면 항원 단백질이 나노구조(정20면체)를 형성하는 특정 단백질과 결합해 면역반응을 유도하는 차이가 있다.
해외에서도 미국 노바백스社가 유전자재조합 기술을 이용한 코로나19 백신의 3상 임상시험을 진행하고 있다.
한편,31일현재 국내에서 개발 중인 코로나19 치료제는 15개(14개 업체)이다.

