식품의약품안전처(처장 김강립)는 국내 개발 코로나19 백신 ‘유코백-19’(유바이오로직스) 임상 1ㆍ2상 시험 계획을 20일 승인했다.
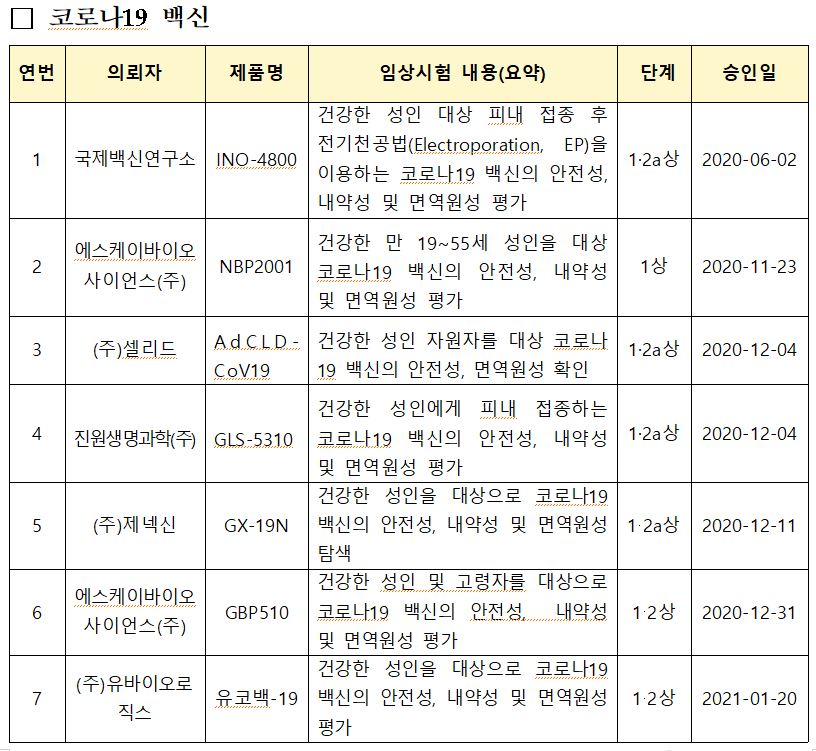
이로써 현재 국내에서 코로나19 관련 임상계획을 승인받아 개발을 진행하고 있는 의약품은 백신 7개 제품, 치료제 15개 제품(13개 성분)으로 나타났다.
이 중 임상 단계인 국내 개발 백신은 DNA 백신(3건), 재조합 백신(3건), 바이러스벡터 백신(1건)이라고 식약처는 밝혔다.
각 백신 개발 기업(연구소 포함)의 임상 단계는 DNA가 국제백신연구소(INO-4800) 1ㆍ2상, 제넥신(GX-19N) 1ㆍ2상, 진원생명과학(GLS-5310) 1ㆍ2상이며 재조합이 SK바이오사이언스의 NBP2001 1상과 GBP510의 1ㆍ2상, 유바이오로직스(유코백-19) 1ㆍ2상으로 집계됐다. 바이러스벡터 백신은 셀리드(AdCLD-CoV19) 1ㆍ2상이다. <표 참조>
이번 임상시험은 건강한 성인을 대상으로 유코백-19의 안전성 및 면역원성을 평가하기 위한 것으로 1상 진행 후 2상을 순차적으로 진행된다. 면역원성은 바이러스 감염성을 없애거나 낮추는 ‘중화항체’ 증가 비율을 말한다.
식약처에 따르면 유코백-19는 코로나19 바이러스의 ‘표면항원 단백질’을 유전자 재조합 기술을 이용해 만든 ‘재조합 백신’으로, 예방원리는 백신의 표면항원 단백질이 면역세포를 자극해 중화항체를 형성함으로써 면역반응을 유도, 코로나19 바이러스가 침입하면 항체가 코로나19 바이러스를 제거하는 방식이다.
유코백-19는 리포좀을 면역증강제로 사용한 백신으로 표면항원 단백질이 리포좀 표면에 표출돼 면역 반응을 유도한다. 리포좀은 지질로 만든 구형이나 타원형 구조체를, 면역증강제는 백신의 면역 반응과 그에 따른 임상적 유효성을 증진시키기 위한 성분을 각각 뜻한다.
한편 외국에서도 미국 노바백스(3상) 등이 유전자재조합 기술을 이용한 코로나19 백신의 임상시험을 진행하고 있다고 식약처는 설명했다.
식약처는 앞으로도 코로나19 치료제 및 백신 개발에 대한 국민적 관심이 높은 점 등을 감안, 개발 제품의 임상 현황에 대한 정보를 신속히 전달하고, 또 안전하고 효과있는 치료제와 백신이 신속히 개발될 수 있도록 지원할 방침이라고 강조했다.

