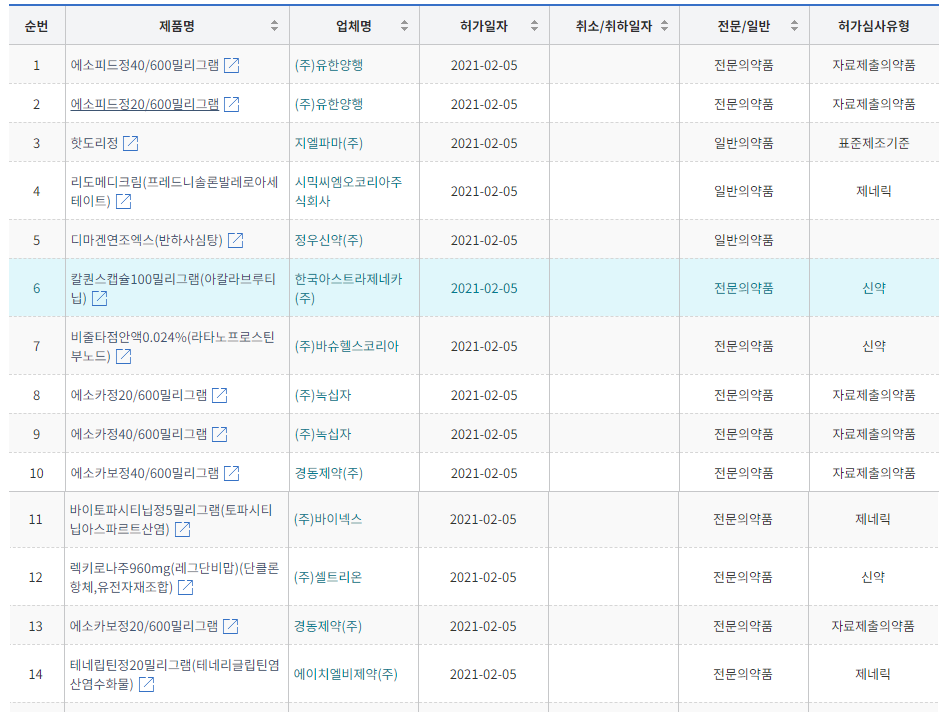
5일 하루에 국산 1호 코로나19 치료제를 비롯해 3개 신약이 동시에 승인됐다.
식품의약품안전처는 셀트리온의 ‘렉키로나주’(레그단비맙)외에 아스트라제네카의 ‘칼퀀스캡슐100mg’(아칼라브루티닙), 바슈헬스社의 ‘비줄타점안액0.024%’(라타노프로스틴부노드)’도 함께 판매허가를 했다.
아스트라제네카의 칼퀸스(Calquence)는 65세 이상 또는 동반질환이 있는 65세 미만의 이전에 치료받은 적이 없는 만성 림프구성 백혈병(CLL) 환자에서 ‘가싸이바’(Gazyva 오비누투주맙)과 병용요법으로 허가 했다.
CLL은 전 세계에서 가장 흔한 성인 백혈병 유형이지만 동아시아에서는 희귀 질환으로 간주되며 백혈병 진단을 받은 환자의 1%~2%가 해당한다. 차세대 선택적 BTK 억제제인 칼퀸스는 일본에서도 CLL 치료제로 승인을 받았다. 일본에서는 임상 3상(ASCEND)과 임상 1상의 긍정적인 결과를 기초로 했다. 임상에서 칼퀸스 단독요법은 현재의 표준 치료법보다 무진행생존(PFS)에서 통계적으로 유의하고 임상적으로 의미 있는 향상을 보여주었다.
바슈헬스社의 신약 비줄타점안액은 개방각 녹내장과 고안압증 안압하강제로 사용이 허가됐다.
식약처는 ‘질환이 있는 눈의 결막낭에 1일 1회 저녁에 1방울’을 권장 용량으로 정하고 투약횟수를 늘리면 안압 하강 효과가 감소할 수 있으므로 1일 1회를 넘겨 투여하지 않아야 한다고 밝혔다. 이 약 경고문에는 색소침착 증가를 꼽았다. 식약처는 색소침착의 변화는 멜라닌 세포 수의 증가 때문보다는 멜라닌 세포내 멜라닌 양의 증가 때문이라고 밝혔다. 이 약 중단 후 홍채의 색소침착은 영구적일 수 있으나 안와 주위 조직의 색소침착과 속눈썹의 변화는 대부분 환자에서 가역적일 수 있다고 경고했다.
식약처는 이날 위식도 역류질환(GERD) 치료제로 녹십자의 ‘에소카정’ 2가지 용량과 유한양행의 ‘에소피드정’ 2가지 용량, 경동제약의 ‘에소카보정’ 2개 용량도 자료제출의약품으로 승인을 했다.