중국의 폐암 치료제들이 최고의 항암제 키트루다(Keytruda)에 맞서는 임상결과를 발표할 수 있을까?
현지시간 9월 8일~14까지 온라인으로 열리는 세계 폐암 학회(World Conference on Lung Cancer)에서 중국 제약사들의 임상 결과에 시선이 집중되고 있다.
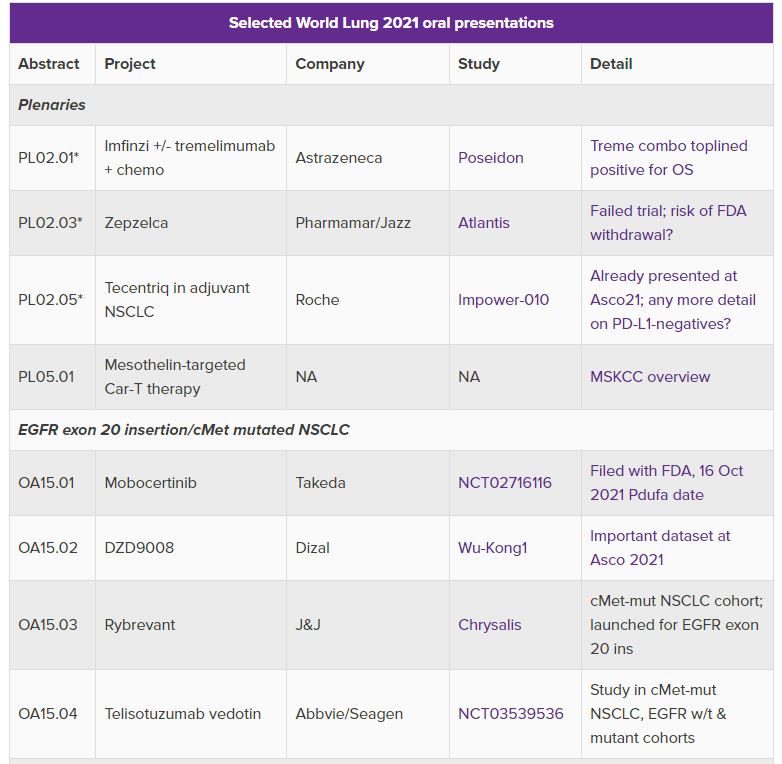
이 컨퍼런스에서는 항 PD-(L)1 MAb에 대한 비소세포폐암(NSCLC) 1차 치료제가 가장 주목을 받을 것으로 예상되며 특히 키트루다에 도전하는 중국 회사들의 임상 결과에 시선이 쏠리고 있다.
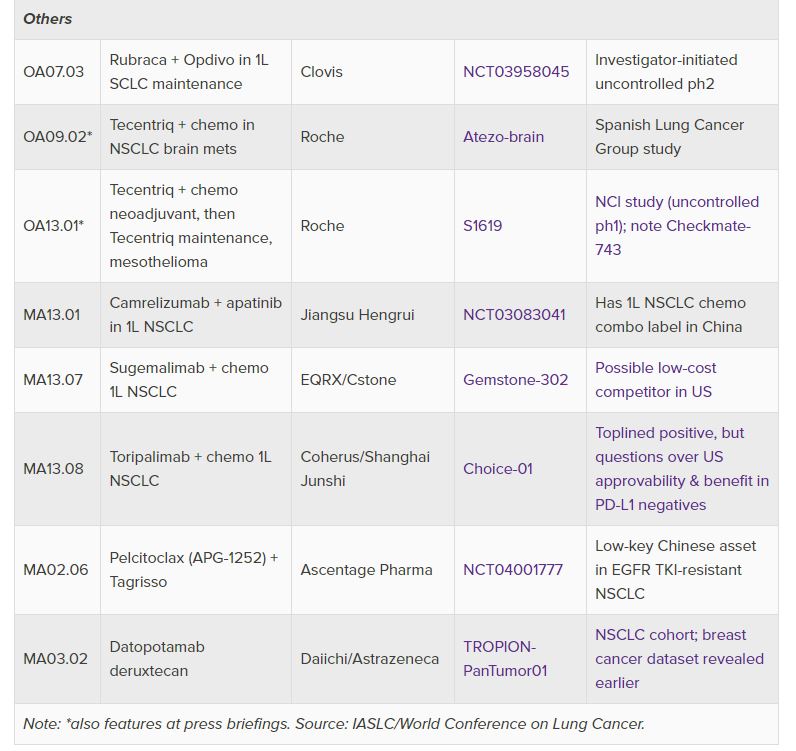
중국 항서제약(Jiangsu Hengrui Medicine)의 면역관문 억제제 ‘아이루이카’(AiRuika 캄렐리주맙), 시스톤 파마슈티컬스(CStone Pharmaceuticals)의 PD-L1 단클론 항체 ‘수게말리맙’(sugemalimab), 상하이 준시 바이오사이언스(Shanghai Junshi Biosciences)의 ‘투오이’(Tuoyi 토리팔리맙) 등의 임상 결과가 9월 13일에 발표된다.
아이루이카와 투오이는 중국에서 허가를 받아 판매되고 있지만 미국 투자자들의 가장 큰 관심은 수게말리맙과 투오이다. 이 두 제품은 각각 EQRX와 코헤러스 바이오사이언스(Coherus BioSciences)를 미국 파트너로 두고 가격 경쟁을 통해 키트루다 아성을 넘보고 있다. 세계 폐학회(World Lung)에 제출한 초록에 따르면 수게말리맙 임상(Gemstone-302)과 투오이 임상(Choice-01)에서 모두 무진행생존기간(PFS) 개선을 보여주고 있으며 화학요법 단독에 비해 전체 생존(OS) 이점을 보여주었다. 다만 이 결과는 초기 데이터로 이번에 발표할 최신 데이터에 관심이 쏠리고 있다.
중국 제품들의 가장 큰 숙제는 중국에서 수행된 임상이 키트루다 임상(Keynote-407 및 189)와 비슷한 생존 데이터를 입증했어도 이것이 미국 FDA 승인을 뒷받침할 자료로 인정될지 여부다. 따라서 중국 치료제들이 임상에서 PD-L1 음성 환자에서의 이점과 중국 NSCLC 1차 치료제 후속 임상 결과를 자세히 살펴봐야 한다.
이번 컨퍼런스에서 또 하나의 초점은 EGFR 엑손 20 삽입 및 cMet 돌연변이 NSCLC에 대한 구두 세션은 급성장하는 표적 치료제 틈새시장에의 경쟁력이다. 임상 결과를 발표하는 중국 다이잘(Dazal) 파마의 ‘DZD9008’은 올해 6월에 개최된 미국임상암학회(ASCO)에서 EGFR 엑손 20 삽입한 53명 환자 사이에 40% 목적반응률을 보였다.
또 하나의 관심은 애브비(Abbvie)-시젠(Sagen 옛 시애틀제네틱스)의 ‘텔리소투즈맙 베도틴’(telisotuzumab vedotin)의 임상결과도 눈길을 끌지만 스포트라이트는 아스트라제네카의 항 CTLA-4 항체 ‘트레멜리무맙’(tremelimumab) 임상(POSEIDON)에 쏠리고 있다. 올해 5월에 아스트라제네카는 4기 전이성 비소세포폐암 환자의 1차 치료제로 임핀지+백금 기반 화학요법 병용요법 또는 임핀지+트레멜리무맙+화학요법 병용요법, 단독 화학요법을 평가한 POSEIDON 임상에서 의미 있는 전체 생존기간(OS) 혜택을 입증했다. 임상의 전체 데이터는 다음 주 목요일(현지시간) 처음으로 공개될 예정이며 같은 날 기자 브리핑 하이라이트로 소개될 예정이다.
이밖에 이번 컨퍼런스에서는 올해 5월에 FDA에 승인을 받은 존슨앤존슨(J&J)의 EGFR 엑손 20 삽입 변이 폐암 치료에 ‘라이브레반트’(Rybrevant)와 FDA 승인 목표일이 올해 10월 26일로 잡혀있는 다케다의 후보물질 ‘모보세티닙’(mobocertinib)도 주목할만한 치료제로 주목을 받고 있다. 라이브레반트는 비소세포폐암 환자의 활성 EGFR 돌연변이 가운데 3번째로 가장 흔한 EGFR 엑손 20 삽입 변이를 표적으로 하는 최초의 완전인간, 이중특이성 항체 치료제로 이번에 MET 엑손(exon) 14 스키핑(skipping) 임상(Chrysalis) 코호트에 관한 결과를 업데이트 한다.
또 애브비-시젠의 항체-약물접합체 텔리소투즈맙 베도틴은 임상 데이터가 거의 없어 이번 발표에 어떤 임상결과를 내놓을 지 주목을 끈다.