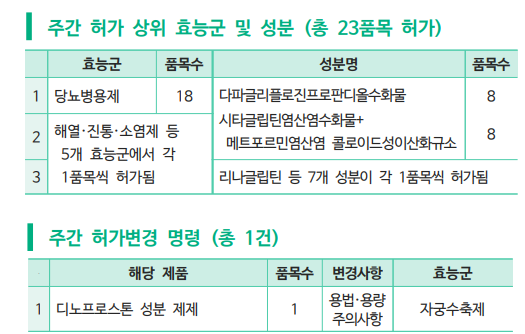
지난주(2월 28일~3월 6일) 당뇨병용제 18개 품목을 포함해 총 23개 품목이 식품의약품안전처로부터 승인을 받았다.<표 참조>
약학정보원(원장 최종수)은 8일 3월 1주차 '주간 허가리뷰'를 통해 의약품 허가와 식별 등록 현황을 공개했다.
주간 허가 리뷰에 따르면 23개 품목 중 효능군별로는 당뇨병용제가 18개 품목으로 대부분을 차지했고 해열ㆍ진통ㆍ소염제 등 5개 효능군에서 1개 품목씩 허가됐다.
당뇨병용제 효능군에서는 기존에 시판 중인 시타글립틴인산염수화물+메트포르민염산염 복합제의 염변경 제품으로 시타글립틴염산염수화물+메트포르민염산염 콜로이드성이산화규소 성분의 ‘시타글렌듀오정’50/500mg(엔비케이제약) 등 8개 품목이 자료제출의약품으로 허가되었다. 더불어 제네릭 제품으로 SGLT-2 억제제 계열의 다파글리플로진프로판디올수화물(dapagliflozin propanediol hydrate) 성분의 단일제 ‘다파린정’5mg(일성신약) 등 8개 품목이 허가되었다.
이외에도 DPP-4 억제제 계열의 리나글립틴(linagliptin) 단일제로 ‘리나네오정’5mg(GC녹십자), 시타글립틴인산염수화물+메트포르민염산염 복합제로 ‘자누맥스엠정’50/1000mg(삼익제약)이 허가되었다.
한편 지난주에는 유도분만제 디노프로스톤 성분 제제 1개 품목의 허가 변경 명령도 있었다.
식약처는 유럽 의약품안전관리기구(HMA)의 안전성 정보 검토 결과 용법ㆍ용량 및 주의사항를 변경했다. 기존 대비 용법ㆍ용량 항목에 ‘이 약은 지속적인 태아 및 자궁 모니터링 시설을 갖춘 전문화된 산과가 있는 병ㆍ의원에서 전문 의료 인력이 투여해야 한다. 삽입 후 자궁 활동과 태아 상태를 주의 깊게 정기적으로 관찰해야 한다’라는 문구와 더불어 ‘1회 투여만을 권장한다’는 내용이 추가되었다. 또 중대한 자궁 경부 수술을 받았거나 자궁 경부의 파열 등 열상이 있는 환자에게 투여해서는 안 된다는 내용으로 주의사항이 수정되었다.
주로 금기 조건에 있는 환자에게 이 약 사용과 관련된 자궁 파열이 보고됨에 따라 관련 내용이 ‘일반적 주의’ 항에 신설되었다. 즉 자궁 파열 및 산과적 합병증과 관련된 위험성 고려 시 제왕절개 또는 자궁 수술 이력이 있는 환자에게 이 약을 사용해서는 안 된다.
더불어 35세 이상의 여성에게 신중히 투여해야 한다는 내용도 주의사항에 추가되었다. 이외에도 흔한 이상 반응으로 ‘자궁 과다 수축’, ‘자궁 과다 자극’, ‘자궁 근육 긴장 항진’이 추가되었고 빈도불명의 이상 반응으로는 ‘태아 사망’, ‘사산’, ‘신생아 사망’이 임상시험에서 보고되어 주의사항에 올랐다.