임상 3상 조건부 허가 의약품 4개 중 1개(25%)는 생산실적이 전무한 것으로 드러나는 등 식품의약품안전처의 허가ㆍ심사에 문제가 많아 심사체계를 전면 개편해야 한다는 지적이 제기되고 있다.

3상 조건부 허가는 암과 희귀병 등 치료가 어려운 환자들에게 신속한 치료 기회를 주기 위해 식약처가 시판 후 임상시험(3상) 자료 제출을 조건으로 승인하는 제도를 가리킨다.
국회 보건복지위원회 백종헌(사진) 의원(국민의힘)은 13일 식약처 국감을 통해 "췌장암치료제인 리아백스, 아토피피부염치료제인 유토마외용액2%, 골관절염치료제인 인보사 등 최근 허가(조건부 허가)와 관련해 계속 문제가 되고 있다"며 "식약처의 허가체계는 기업의 내부 고발이 없으면 조작ㆍ허위 자료 제출 여부를 자체적으로 확인하기 어려운 실정”이라고 밝혔다.
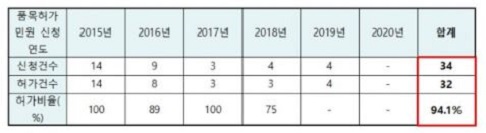
이날 백 의원은 식약처가 제출한 3상 시험 조건부 허가 현황 자료를 공개했다. <표 참조> 이 자료에 따르면 5년간(2015~2019년) 조건부로 허가된 의약품 32개 중 8개가 생산실적이 아예 없었으며, 2010년부터 10년간 의약품 포함 의료제품 781품목의 허가가 취소됐다.
또 지난 10년간 보완이 요청된 품목은 1만6528개로 전체의 약 절반을 차지했다. 최근 허가된 10개 의약품이 허가ㆍ심사를 받기 위해선 제출된 평균 서류량만도 24만7210페이지, 1인당 처리 건수는 61.3건으로 조사됐다.
이와 관련해 백 의원은 "심사관 1명이 연간 1500만 페이지를 검토해야 하는 상황"이라며 "미국과 유럽과 비교하기 어려울 만큼 심사 자료량이 너무 많다"고 지적했다.
백 의원은 "이는 바꿔 말하면 허가를 요청하는 업체 다수가 제대로 서류를 갖추지 못한 채 무작정 식약처에 품목 허가부터 신청하는 사실을 증명한다"며 "이를 개선하기 위해선 의약품 등 허가ㆍ심사체계가 전면 개편돼야 한다"고 강조했다.
특히 백 의원은 "현재 3상 조건부 허가 지침이 있지만, 조건부 대상을 명확히 하는 등 허가 후 조건부 허가에 대한 분명한 법적 근거 마련이 필요하다"며 "조건부 허가에 대한 지속적 불식하기 위해 기업의 조건 이행력 확보를 위해 행정처분 규정 세분화, 실태조사 및 감시체계를 강화하는 내용으로 법 개정이 요구된다"고 말했다.

